<水の科学10>水分子同士は水素結合で結ばれる

水分子はどのように結合しているのでしょうか。
水分子では、水素と酸素の電気陰性度の差が大きい。共有電子対はほとんど酸素原子のほうに引き寄せられ、強い極性を生じます。
水素原子と酸素原子の共有結合では、2 つの原子の電気陰性度の差が大きいため、共有電子対が電気陰性度の大きい酸素原子に偏って、酸素原子は負に帯電し、水素原子は正に帯電します。
その結果、水素原子が直接結合していない、隣の水分子の酸素原子部分とクーロン力で強く引き合います。これを水素結合といいます。
この結合によって水は、水分子同士が結び付いた集合体をつくります。その形に規則性はなく、絶えず切れたりつながったりしながら運動しています。
水の特殊な性質のうち、水素結合に原因があると考えられているものはいくつかあります。
水、硫化水素(H2S)、水素化セレン(H2Se)、水素化テルル(H2Te)の融点、沸点を比較について前述しました。
水以外の3 物質は、分子量が大きいほど融点、沸点とも高くなっていきます。しかしながら、水は分子量がいちばん小さいにもかかわらず融点、沸点ともに飛び抜けて高い値を示しました。
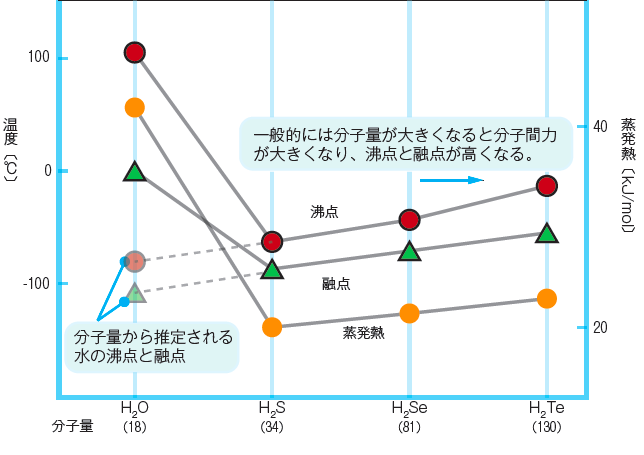 水素結合を有する物質の沸点・融点は高い
水素結合を有する物質の沸点・融点は高い
そこには水素結合が関係しています。水素結合をもつ物質は、同程度の分子量で似たような分子構造をもつ物質に比べて、融点や沸点が異常に高く蒸発熱が大きい。水素結合をもつ物質は、結晶格子をくずしたり(融解)、分子同士を完全に引き離したりする(蒸発)には、水素結合をもたない物質に比べて、より大きなエネルギーを必要とします。

