<水の科学11>氷の分子は隙間が多い
液体の水は、水素結合によって強く結びついています。
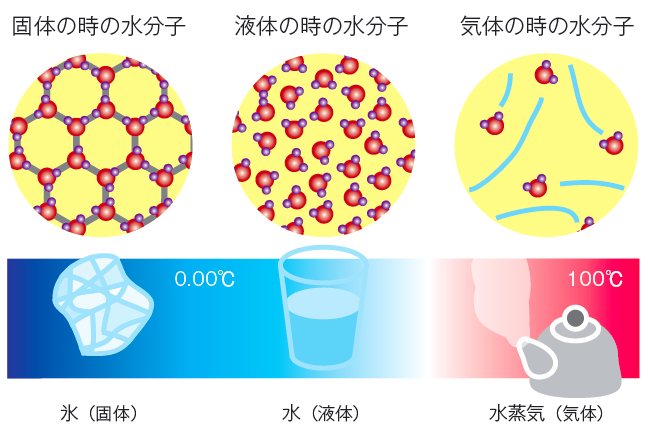
固体になると、1つの水分子が4つの水分子と手をつないだ正4 面体が、連続的につながったダイヤモンドに似た構造になります。
水素結合は、正4 面体型局所配置を好み、秩序化するほど隙間が大きくなるという特徴があります。
このことが、氷の密度が液体の水よりも小さい原因です。
氷を加熱していくと0℃で融解し、体積は約1 割減少します。これは隙間の多い構造が一度に崩れるためですが、すべてなくなるわけではありません。
さらに温度を上げると物体は熱膨張するので、その体積の増加と隙間の多い構造がなくなる体積減少の兼ね合いから、3.98℃で水の密度は最大になります。
水分子は窮屈に詰まっているため、分子同士の隙間が大きい氷よりも密度が大きい。水の沸点が高いことや蒸発熱が大きく、表面張力が大きいことなどは、水が巨大なネットワークをなかなか崩さないためでもあります。
しかしながら水素結合の実態は、まだわからないことが多いのです。2013 年、理化学研究所原田慈久氏らの研究チームは、液体の水の水素結合が作り出すネットワーク構造は「ミクロ不均一モデル」であることを裏付けることに成功したと発表しました。
それまでは1930 年代にエックス線構造解析によって考えられた「連続体モデル」が通説でした。これは、氷の時と同じように4 個の分子が正4 面体をつくって固まっており、それが若干のゆがみがあっても同じ構造が続く連続体であるという考え方です。
「ミクロ不均一モデル」は、つながった状態とつながりが切れた状態の2 つが入り交じっているという考え方です。
液体の水は、水素結合様式の異なる状態が共存することがわかりました。水分子同士がさまざまな距離、角度で隣接し、場合によっては水分子同士を結び付けている水素結合の紐が切れたものもありました。
さらに通常の水素で構成される水素結合の紐のほうが、重水素で構成される水素結合の紐よりも切れている確率が高い可能性があることもわかりました。
通常の水素で構成される軽水と呼ばれる水と重水素で構成される重水と呼ばれる水では、軽水のほうが沸点や融点が低いこともわかっています。
今後、水素結合について詳細に解明されるにつれ、水の不可解な性質も少しずつわかっていくことでしょう。

