<水の科学9>共有結合する水分子

ここでは水の性質を、水の構造を見ながら考えていきましょう。
水の分子(H2O)は1 個の酸素原子(O: 原子量16)と2 個の水素原子(H: 原子量1)が結合した3 原子分子(分子 量:18)です。
2 つの水素原子と1 つ酸素原子(H‒O‒H)は、それぞれ不対電子を出し合い、共有電子対を作ることにより結合します。こうした結合を共有結合といいます。酸素は最外殻の電子が2 つ不足しており、それを水素原子で補うように共有しています。
ただし、酸素原子を挟んで2 つの水素原子が直線状に並んでいるわけではありません。酸素が頭、水素が手の「やじろべえ」のような形で結合しており、水素‒酸素‒水素がなす角度は104.5°です。
原子が共有電子対を引き寄せる度合いを電気陰性度といいます。電気陰性度の高い原子は、フッ素原子、酸素原子、窒素原子などです。これらの原子が、水素原子のように電気陰性度の小さい原子と結合すると、電子が大きいほうに引き寄せられて、電気的な偏りが生じます。
もし水分子が、酸素原子を挟んで2 つの水素原子が直線状に並んでいるとしたら、原子のもつ電気陰性度を互いに打ち消しあっていることになります(このような分子を無 極性分子といいます)。
しかし、そうではなく104.5°という角度があるので、分子全体として電気的な偏りをもっていることになります。このような分子を極性分子といいます。
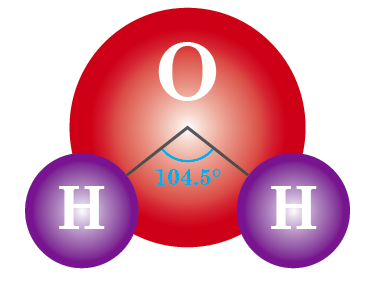
104.5°の角度で2 つの水素原子が酸素原子に結合している

